一、服务介绍
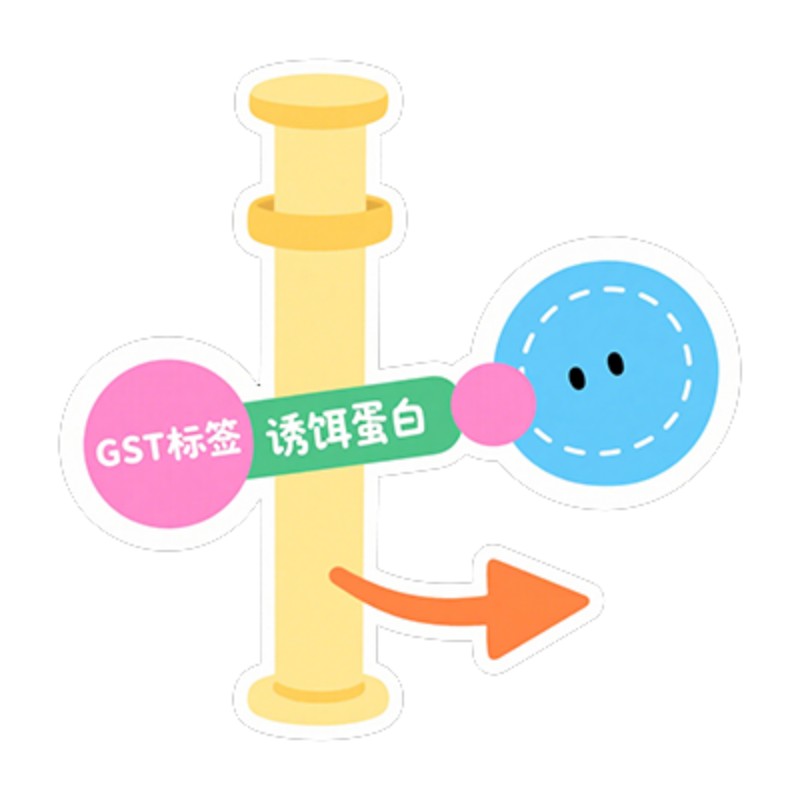
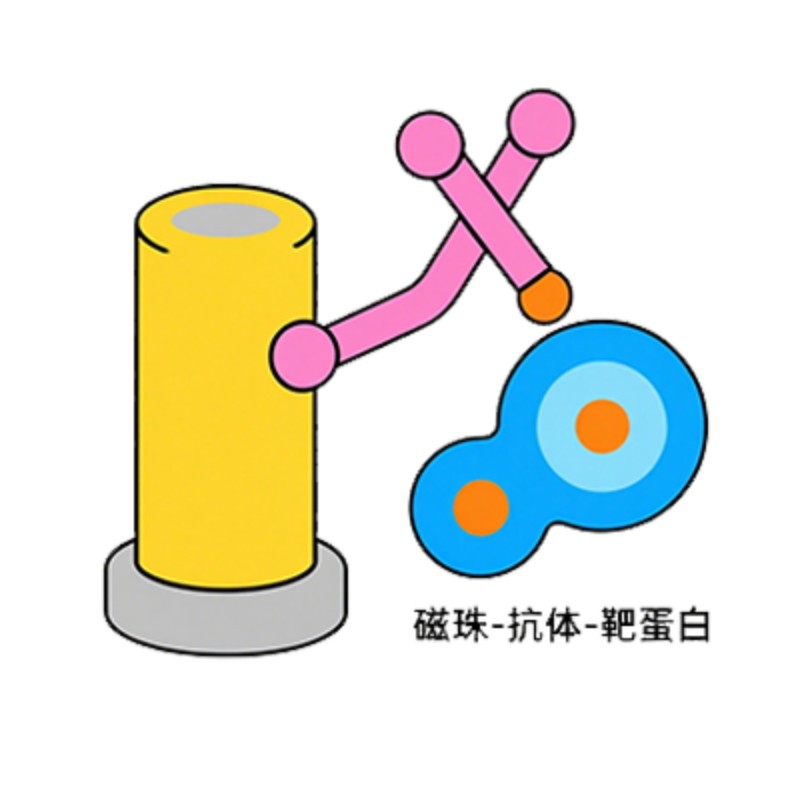
将一个已知蛋白作为 “诱饵”,通过基因工程技术给其添加一个特异性标签(如 GST、His、Flag 等)。将带标签的诱饵蛋白与对应的亲和介质(如 GST - 谷胱甘肽树脂、His-Ni²⁺树脂)结合,使诱饵蛋白被固定在介质表面。将固定有诱饵蛋白的介质与含潜在 “靶蛋白” 的样品(可以是细胞裂解液、纯化的蛋白等)共同孵育。若靶蛋白与诱饵蛋白存在特异性相互作用,就会被诱饵蛋白捕获,形成 “诱饵 - 靶蛋白复合物” 并结合在介质上;无相互作用的杂蛋白则游离在溶液中。
二、亮点和服务特色
2.1 亮点
1)蛋白间相互作用 2)高特异性 3)高灵敏度 4)适用于多种生物体系
2.2 服务特色
GST Pull-Down 是一种基于亲和层析和蛋白质 - 蛋白质相互作用的体外实验技术,核心目的是验证两种已知蛋白质是否存在直接相互作用,或从复杂样品(如细胞裂解液)中筛选出与目标蛋白质结合的未知互作蛋白。
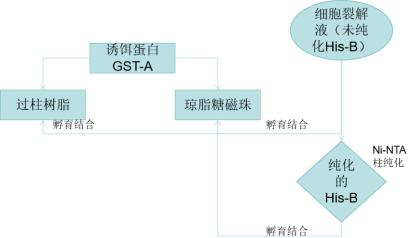
三、 服务优势
1. 高特异性:实验的特异性由 “亲和标签 - 载体” 和“蛋白 - 蛋白互作” 双重机制保障,大幅减少非特异性结合带来的干扰。
2. 灵活可控:GST Pull-Down 的体外实验体系具有极强的灵活性,可根据研究目标自由调节关键条件,满足多样化需求。
3. 直接验证:GST Pull-Down 是体外重建的简化体系:实验中仅包含 “GST - 诱饵蛋白”、“猎物蛋白”(及必要缓冲成分),若能检测到猎物蛋白,可直接证明二者存在不依赖其他内源蛋白的直接相互作用。
四、 服务流程

五、客户提供
蛋白序列信息
1. 提供载体/模板:需要提供载体mcs测序报告/模板测序结果,如:测序报告则需另外收取测序费,由载基代为测序。
2. 提供菌液:菌液量应≥0.5mL,放置1年以上的油菌需活化后送样。
3. 提供质粒:质粒量≥5μg。
4. 菌液和液态质粒均需冰袋运输。
六、实验交付
1. 剩余质粒;
2. 蛋白表达鉴定SDS-PAGE结果、蛋白纯化表达SDS-PAGE结果,蛋白Western Blot鉴定结果;
3. 结题报告以及全部原始数据。
七、服务说明
1. 可根据样本蛋白序列及基因序列进行蛋白表达预测分析,选择合适的载体与菌株,构建载体后进行诱导表达与蛋白纯化;
2. 小量诱导蛋白表达SDS-PAGE、大量蛋白纯化进行互作实验分析;
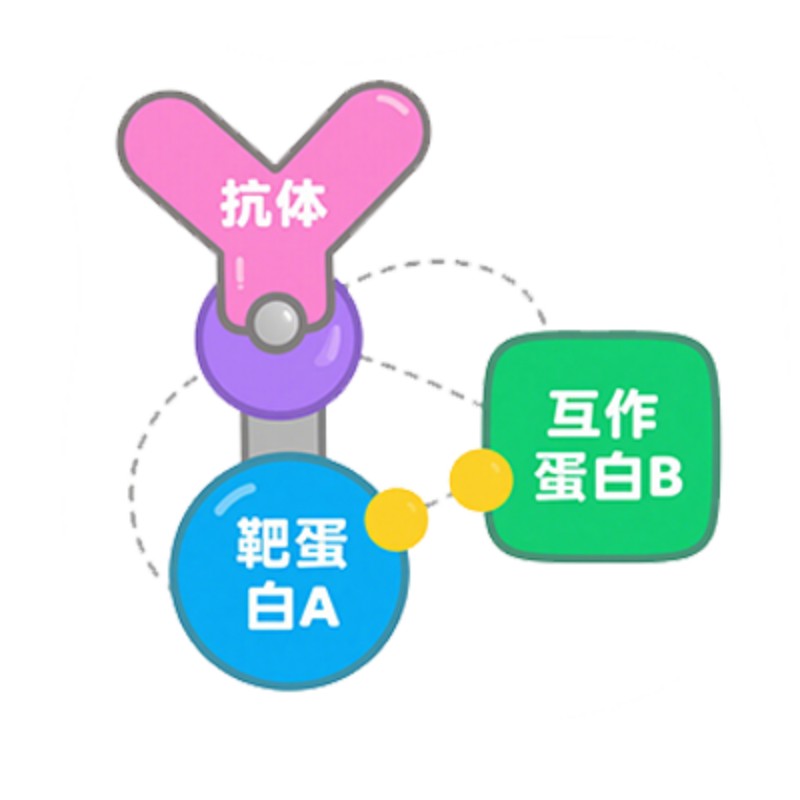
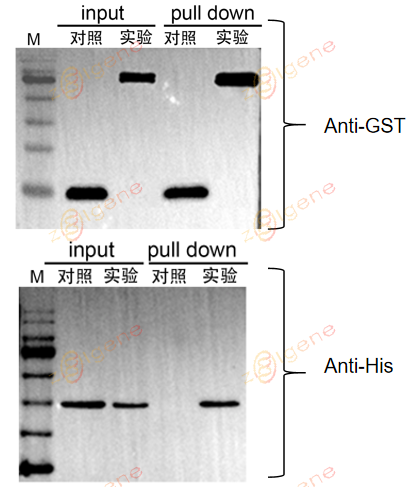
3. 在阴阳对照正常的前提下,若实验组IP中检测到另一蛋白条带,阴性对照中没有,说明两个蛋白能够互作,反之说明不互作。
|
服务名称 |
服务内容 |
交付内容及标准 |
周期 |
|
质粒构建 |
基因克隆 |
1、测序验证报告 2、包含表达质粒的大肠杆菌DH5a/TOP10 3、表达质粒 |
20个 工作日 |
|
同源重组 |
|||
|
质粒转化表达载体 |
|||
|
蛋白表达纯化 |
转化表达宿主菌株 |
4、阳性表达菌株 5、小试表达报告 6、蛋白表达报告 7、成品蛋白3mg |
20个 工作日 |
|
表达小试 |
|||
|
扩大培养 |
|||
|
亲和纯化 |
|||
|
SDS-PAGE、WB |
八、案例展示
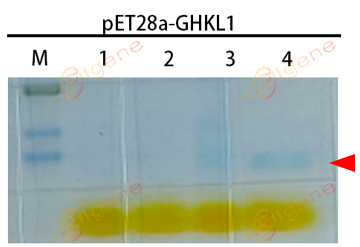
1取自未诱导的菌液,2取自诱导后的菌液,3取自超声破碎后的菌沉淀,4取自超声破碎后的上清。
九、相关资源
1、GST-pull down 技术应用
1) 蛋白质互作验证:直接验证体外条件下两个或多个已知蛋白质之间的特异性相互作用,明确互作的直接性与结合强度。
2) 未知互作蛋白筛选:以目标蛋白为诱饵,从细胞裂解液、组织提取物等复杂样品中捕获并鉴定潜在的互作蛋白,挖掘新的功能关联分子。
3) 蛋白质结合结构域分析:通过构建诱饵蛋白的截短体或突变体,确定介导蛋白质相互作用的关键结构域或氨基酸位点。
4) 蛋白质 - 核酸互作研究:检测蛋白质与特定 DNA 或 RNA 序列的结合能力,如转录因子与启动子的相互作用、RNA 结合蛋白与靶标 RNA 的结合等。
5) 药物研发辅助:筛选能干扰或促进特定蛋白质相互作用的小分子化合物,评估候选药物对靶标互作的影响,为药物靶点验证提供依据。
6) 信号通路解析:鉴定信号通路中关键蛋白的上下游互作分子,阐明信号传递的分子机制,如激酶与底物、受体与配体之间的相互作用关系。
7) 微生物学研究:探究病原微生物蛋白与宿主细胞蛋白的相互作用,揭示病原体入侵、感染及致病的分子机制。
8) 蛋白质翻译后修饰对互作的影响:分析磷酸化、泛素化等翻译后修饰是否调控蛋白质之间的相互作用,以及修饰后的互作强度变化。
2、GST-pull down 实验流程
1) 构建与表达 GST 融合蛋白:设计特异性引物扩增目的基因(诱饵蛋白),将其与 GST 标签基因融合并克隆到原核表达载体中,转化大肠杆菌后通过 IPTG 诱导表达 GST - 诱饵融合蛋白,经亲和层析纯化获得高纯度融合蛋白。
2) 制备待检测样品:若检测与已知蛋白的互作,需表达并纯化该目标蛋白(可带 His 等标签便于后续检测);若筛选未知互作蛋白,则裂解细胞或组织,离心取上清获得总蛋白提取物。
3) 孵育与结合:将纯化的 GST - 诱饵融合蛋白与 GST 亲和树脂孵育,使融合蛋白通过 GST 标签结合到树脂上;加入待检测样品(目标蛋白或总蛋白提取物),在适宜条件(如 4℃)下缓慢摇晃孵育,让互作分子充分结合。
4) 洗涤与分离:用含不同浓度盐离子的缓冲液多次洗涤树脂,去除非特异性结合的蛋白;加入洗脱缓冲液(如含还原型谷胱甘肽)洗脱结合的蛋白复合物。
5) 检测与分析:通过 SDS-PAGE 分离洗脱的蛋白复合物,若为已知互作蛋白,可经 Western Blot(用标签抗体或特异性抗体)验证;若为筛选未知蛋白,则对凝胶中的特异性条带进行质谱鉴定,确定互作蛋白身份。
3、GST-pull down 实验优化与注意事项
1) 融合位点选择需避开诱饵蛋白的功能结构域(如结合活性位点、酶活中心),避免 GST 标签干扰蛋白互作;优先选择 N 端或 C 端融合(若某一端融合影响蛋白折叠,可尝试另一端)。
2) 确保融合蛋白正确折叠与活性:通过 SDS-PAGE 验证纯化后蛋白的纯度(目标条带单一,无明显杂带),若需进一步确认活性,可结合酶活实验(针对酶类诱饵)或已知互作蛋白的预实验(验证结合能力),避免因蛋白错误折叠导致假阴性。
3) 温度与时间:常规选择 4℃孵育(减少蛋白降解,降低非特异性结合),孵育时间需根据互作强度调整(弱互作可延长至 12-16 小时,强互作 4-6 小时即可),避免过短导致结合不充分或过长增加非特异性结合。
4) 缓冲液成分:缓冲液需含温和的盐离子(如 100-150mM NaCl,过高易破坏互作,过低增加非特异性结合)、蛋白酶抑制剂(如 PMSF、蛋白酶抑制剂 cocktail,防止蛋白降解)和磷酸酶抑制剂(若研究磷酸化依赖的互作);可添加 0.1%-0.5% Triton X-100 增强蛋白溶解性,但需避免高浓度去污剂破坏蛋白互作。
5) 洗涤缓冲液需与孵育缓冲液成分一致(仅可调整盐浓度),通过梯度提高盐浓度(如从 150mM 逐步升至 300mM NaCl)去除非特异性结合蛋白,同时需检测目标互作是否被高盐破坏(可通过预实验验证)。
6) 洗涤次数与体积:每次洗涤需用至少 10 倍树脂体积的缓冲液,反复洗涤 3-5 次,确保充分去除未结合或弱结合的杂蛋白,但避免过度洗涤导致特异性复合物脱落。
7) 对照实验的设置(关键防假阳性 / 假阴性):阴性对照:① 仅用 GST 蛋白(无诱饵片段)与树脂结合后孵育待检测样品,排除 GST 标签本身与目标蛋白的非特异性结合;② 待检测样品单独与树脂孵育,排除样品中蛋白与树脂的非特异性吸附。阳性对照:使用已知与诱饵蛋白互作的蛋白作为待检测样品(如已报道的互作对),验证实验体系的有效性,确保实验流程无技术误差。
8) 待检测样品(细胞 / 组织裂解液)需新鲜制备,避免反复冻融导致蛋白降解;离心时需保持低温(4℃),且转速足够(如 12000g 离心 15 分钟),确保去除细胞碎片,避免杂质干扰结合。
9) 检测方法选择:若验证已知互作,Western Blot 需使用特异性抗体(如目标蛋白的标签抗体或自身抗体),确保抗体特异性(无交叉反应);若筛选未知互作,SDS-PAGE 凝胶需选择合适浓度(根据目标蛋白分子量),且质谱鉴定前需切取清晰的特异性条带(避开 GST 诱饵蛋白条带),减少杂蛋白干扰。
10) 纯化过程中需避免反复冻融 GST 融合蛋白,可将纯化后的蛋白分装保存于 - 80℃,并添加 50% 甘油提高稳定性,防止蛋白变性影响后续结合实验。